MathEnvision:
Physikalische
Beispiele
Elektronische Zustände (Orbitale)
des Wasserstoffatoms:
In den folgenden Bilder sind die Orbitale 1s bis 5g des Wasserstoffatoms dargestellt. Auf der linken Seite ist jeweils eine Isofläche dargestellt, auf der die Aufenthaltswahrscheinlichkeit für ein Elektron bei 0.0015 = 0.15% liegt. Diese Isofläche gibt somit die Form des Orbitals wieder. Auf der rechten Seite ist ein Querschnitt durch das jeweilige Orbital dargestellt, deren Farbe die Größe der örtlichen Aufenthaltswarschinlichkeit angibt (siehe Farblegende am Ende dieser Seite). Weitere Info's zu Orbitalen und Aufenthaltswahrscheinlichkeiten finden Sie auf www.wikipedia.de. Alle diese Diagramme wurden mit MathEnvision erstellt. Für ein einfaches Rechnen mit denn Wellenfunktionen für das Wasserstoffatom sind diese bereits fest in MathEnvision integriert und können über die Parameter (n,l,m = Qunatenzahlen, siehe Erläuterung unten) einfach aufgerufen werden. Die Formelkollektion für diese Orbitale können sie hier herunterladen. |
||
1s Orbital (n = 1, l = 0, m = 0):
2s Orbital (n = 2, l = 0, m = 0):
2p Orbital (n = 2, l = 1, m = 0):
2p Orbital (n = 2, l = 1, m = ±1):
3s Orbital (n = 3, l = 0, m = 0):
3p Orbital (n = 3, l = 1, m = 0):
3p Orbital (n = 3, l = 1, m = ±1):
3d Orbital (n = 3, l = 2, m = 0):
3d Orbital (n = 3, l = 2, m = ±1):
3d Orbital (n = 3, l = 2, m = ±2):
4s Orbital (n = 4, l = 0, m = 0):
4p Orbital (n = 4, l = 1, m = 0):
4p Orbital (n = 4, l = 1, m = ±1):
4d Orbital (n = 4, l = 2, m = 0):
4d Orbital (n = 4, l = 2, m = ±1):
4d Orbital (n = 4, l = 2, m = ±2):
4f Orbital (n = 4, l = 3, m = 0):
4f Orbital (n = 4, l = 3, m = ±1):
4f Orbital (n = 4, l = 3, m = ±2):
4f Orbital (n = 4, l = 3, m = ±3):
5s Orbital (n = 5, l = 0, m = 0):
5p Orbital (n = 5, l = 1, m = 0):
5p Orbital (n = 5, l = 1, m = ±1):
5d Orbital (n = 5, l = 2, m = 0):
5d Orbital (n = 5, l = 2, m = ±1):
5d Orbital (n = 5, l = 2, m = ±2):
5f Orbital (n = 5, l = 3, m = ±1):
5f Orbital (n = 5, l = 3, m = ±1):
5f Orbital (n = 5, l = 3, m = ±2):
5f Orbital (n = 5, l = 3, m = ±3):
5g Orbital (n = 5, l = 4, m = 0):
5g Orbital (n = 5, l = 4, m = ±1):
5g Orbital (n = 5, l = 4, m = ±2):
5g Orbital (n = 5, l = 4, m = ±3):
5g Orbital (n = 5, l = 4, m = ±4):
| Erläuterungen: | ||||
| n | Hauptquantenzahl | |||
| l | Drehimpulsquantenzahl (Nebenquantenzahl) | |||
| m | magnetische Quantenzahl des Drehimpuls (azimuthale Quantenzahl) | |||
| Farblegende für die Querschnitte (räumliche Aufenthaltswahrscheinlichkeit): | ||||
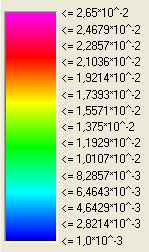 |
Die Zahlen auf der linken Seite gibt die räumliche Aufenthaltswahrschenlichkeiten für ein Elektron an, dass sich in einem der Orbitale befindet. Diese Aufenthaltswahrscheinlichkeit ist hier auf 1 normiert (1 = 100%). | |||
Bei Fragen wenden Sie sich gerne an uns: Email-Support